医疗器械临床试验服务
根据《医疗器械监督管理条例》规定,第Ⅰ类医疗器械实行产品备案管理,不需要进行临床试验,但需要提交临床评价资料;第Ⅱ、Ⅲ类医疗器械注册时,应当进行临床试验(免于进行临床试验的第Ⅱ、Ⅲ类医疗器械除外);免于进行临床试验的医疗器械,在进行注册申报时,需提供临床评价资料。
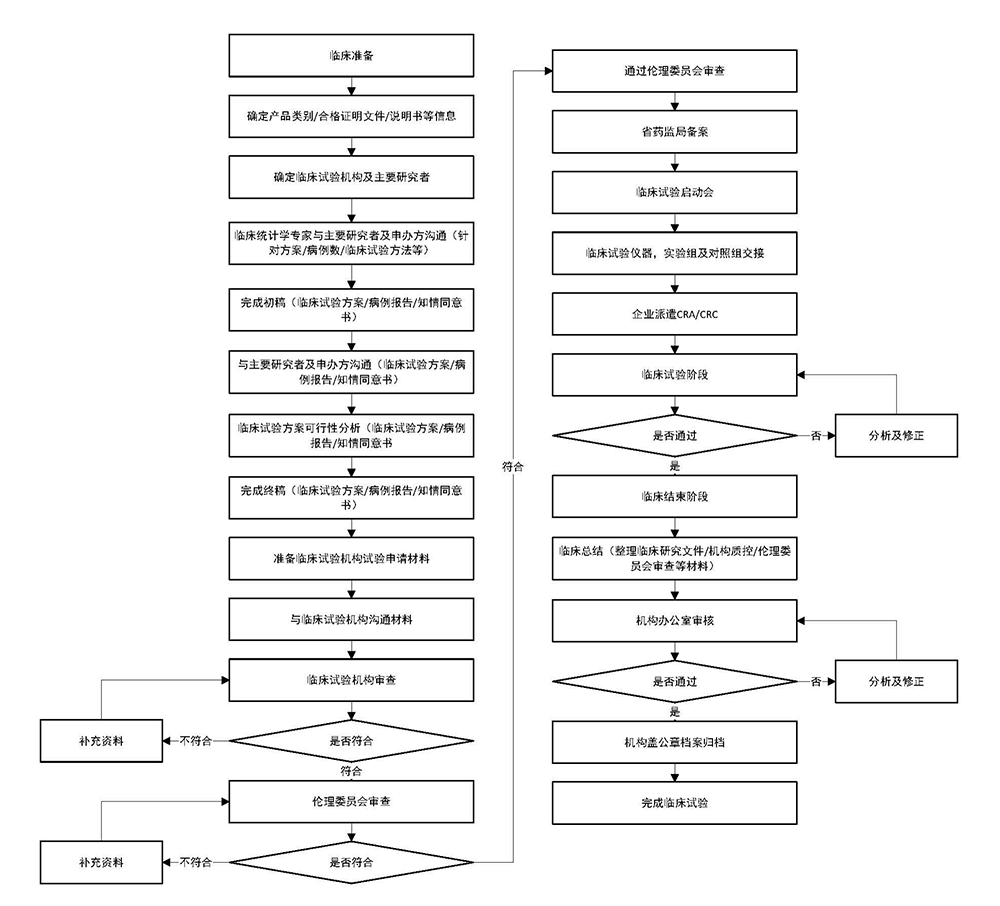
一、 临床试验服务
1、 为客户确定是否临床试验豁免,如不需要临床试验提供临床试验资料起草及制定的服务。
2、 提供临床试验基地的选择及联络接洽相关的服务。
3、 提供临床试验方案、CRF表格起草及咨询的服务。
4、 提供临床试验批件提交、备案、不良事件报告等服务。
5、 提供整个临床试验开启至关闭全程跟踪并取得报告的服务。
二、 CRC服务
CRC团队在研究中心协助临床试验机构进行现场管理和具体操作的非医学专业服务,致力于通过提供临床试验相关的专业服务,协助研究者和研究机构承担在临床试验中非医生判断类的事务性工作,提高临床试验质量和进度,推动临床试验规范化进程。
1 为申办方/CRO提供的服务
项目可行性调研、伦理递交、研究者会议组织、受试者招募、研究中心信息收集、试验预算管理、研究相关培训、内部稽查、临床试验项目管理、试验物资和试验文件管理
2 为研究机构/研究者提供的服务
临床试验管理、专业临床研究协调员(CRC)配备、研究文档的管理、受试者招募与管理、研究物资管理、数据管理、伦理和机构的沟通、安全信息的管理、研究中心管理、研究中心SOP的建立和完善、机构认证辅导、研究者及其他参与人员的培训、协助机构对在研项目的稽查、协助接受SFDA现场核查、费用协商。